您现在的位置是: 首页 > 招生信息 招生信息
江苏化学高考模拟_江苏化学模拟试卷
tamoadmin 2024-05-18 人已围观
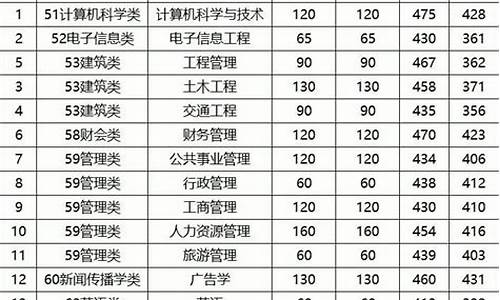
简介看图。因为Ni是常见的加成H2的催化剂,反应1、2都是加成H2的反应。因此是反应1、2的催化剂图中表现为:在一定范围内,随着镍粉用量的增加,产生甲烷的速率(斜率)不断增加、H2的消耗速率也不断增加CD 本题属于基本理论中化学平衡问题,主要考查学生对速率概念理解与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。 A.在I中充入1molC

看图。
因为Ni是常见的加成H2的催化剂,反应1、2都是加成H2的反应。
因此是反应1、2的催化剂
图中表现为:
在一定范围内,随着镍粉用量的增加,产生甲烷的速率(斜率)不断增加、H2的消耗速率也不断增加
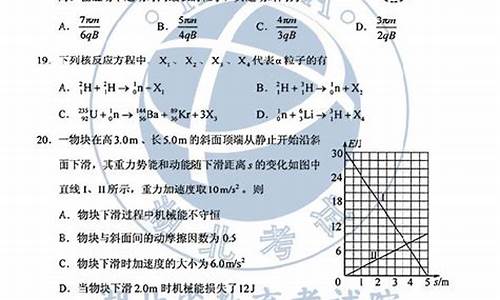
CD 本题属于基本理论中化学平衡问题,主要考查学生对速率概念理解与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。 A.在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,刚开始时,容器I、中正反应速率最大,容器II中正反应速率为零。达到平衡时,容器I温度大于700℃,容器II温度小于700℃,所以,容器I中正反应速率大于容器II中正反应速率。 B.容器III可看成容器I体积压缩一半,各物质浓度增加一倍,若温度恒定,则平衡不移动;但恒容绝热的情况下,容器III中温度比容器I高,更有利于平衡向逆反应方向移动,故平衡常数容器III小于容器I。 C.若温度恒定,容器I、II等效,但两者温度不等。达到平衡时,容器I温度大于700℃,容器II温度小于700℃,有利于容器I平衡向逆反应方向移动,故容器I中CO的物质的量比容器II中的多。 D.若温度恒定,容器I、II等效,容器I中CO的转化率与容器II中CO2的转化率之和等于1。但两者温度不等,达到平衡时,容器I温度大于700℃,容器II温度小于700℃,有利于容器I平衡向逆反应方向移动,有利于容器II平衡向正反应方向移动,故容器I中CO的转化率相应减小,容器II中CO2的转化率同样会相应减小
上一篇:考研分数线构成,考研分数划线规则