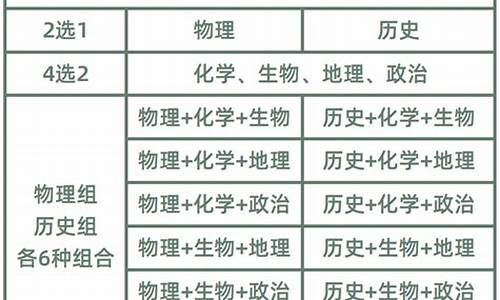
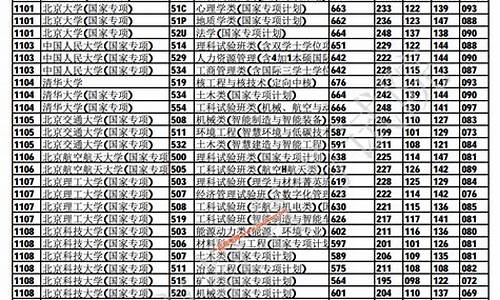
您现在的位置是: 首页 > 教育政策 教育政策
高考物质的量,高考物质的量专题
tamoadmin 2024-06-07 人已围观
简介1.上海化学高考题2.2020高考化学必背的知识点化学平衡和化学反应途径一事无成。即在相同条件下,反应是可逆反应的开始处或从逆反应开始,或从起始反应物中的其他产品,来达到同样的化学平衡的状态下,平衡混合物的组合物中的百分含量的材料保持不变,这是等效的平衡。从上面的介绍,同样的平衡,相似,等效平衡平衡不同,同一资产负债余额是指同一类计算几种不同的手段相似,但余额的比例均衡关系具有阶级基础,和等效平衡
1.上海化学高考题
2.2020高考化学必背的知识点

化学平衡和化学反应途径一事无成。即在相同条件下,反应是可逆反应的开始处或从逆反应开始,或从起始反应物中的其他产品,来达到同样的化学平衡的状态下,平衡混合物的组合物中的百分含量的材料保持不变,这是等效的平衡。从上面的介绍,同样的平衡,相似,等效平衡平衡不同,同一资产负债余额是指同一类计算几种不同的手段相似,但余额的比例均衡关系具有阶级基础,和等效平衡是相当于用一种平衡的方式思考和解决问题的方法解决问题。
条件创建相同资产或类似条件与外界的平衡,一个不变的文珩蓉,二是恒定的温度和压力。
①在恒定的温度,只放(前系数比方程是不一样的),只要材料进行初始物质的量都是平等的,你可以创建相同的平衡。两个平衡的所有对应的平衡量(包括正向和反向的反应速率,各组分分数物质的浓度,气体的体积分数,质量等)的材料的量是完全相等的。 (方程的系数比前相同),只要该材料允许的初始摩尔比等于可以创建类似的平衡。平衡关系,是平等的关系。两个组件的材料平衡点的数量,气体体积分数,质量分数,反应物,对应于相同的转化率;两个逆反应速率的平衡,平衡的组件的物质的量和物质的量的浓度成正比。 />②在一个恒定的温度,恒定压力
只要每种物质的初始浓度成正比建立类似的平衡。即两个平衡关系的关系类似。两个平衡平衡组件的结合的物质的物质的量的小部分气体的体积分数,质量分数,反应物等对应于相同;两个CKS和积极的平衡,每个相应的逆成反比的转化率率;和两个平衡平衡的物质在反应容器的体积相对应的每种物质的量是成比例的。如果你真的无法理解,你可以考虑使用的理想气体状态方程PV = NRT P:压力量V:N:物质的量R:普适常数T:热力学平衡温度
等效分类和判断力:(1),改变起始原料加入的物质的量,如通过可逆反应的化学计量学转化为同一半的物质的物质的量等于原有的平衡的平衡常数文珩戎原来的平衡当量(2)根据常数文珩戎,反应气体中之前和之后都相等的物质的量和可逆反应的反应产物(或产品)的物质的量之比在相同原来的平衡,平衡两个相等的(3)在恒定的温度和压力下,添加的材料的量,只要转换到的同一侧的材料相同的材料的量的比为化学计量的数量,改变起始材料原有的平衡,平衡的原始平衡当量注:
1,平衡当量,转化率不一定相同
①如果建立平衡转化率相当于从不同的方向物质必须是不同的。如果在某一温度下在密封的反应容器中定容2M(克)+ N(克)= 2E(g)中的气体如果初始充电2molE的,为了平衡压力增加时,最初的20%的比例, E 40%的转化率;如果开始下,填充2molM和1molN,达到平衡时,M的转化率为60%。 ②如果从一个方向相当于建立平衡,转化率相同的物质。恒定的温度和压力的反应容器2E(克)= 2M(克)+ N(g)项,如果开始灌装4molE如果初始充电2molE的,平衡物质的量的中号0.8mol,E 40%的转化率; ,达到平衡时M为1.6mol的材料的量,则E的转化率仍然是40%。 2,平衡相当量的物质的组件不一定相同片面材料/>①,相应的量相等的量相当于开始平衡时,平衡量的材料,每个组件相等。 ②原料双面,相应金额不等于起始体积(它们的比值不等于1)的部件的材料的量是不相等的等效平衡平衡,但各组分的量的分数等于的材料。等效平衡问题,因为它涵盖了知识渊博的远征灵活,思维能力的要求比较高,已研究和检讨学生的化学平衡“这部分的内容,最大的困难。近年来,相当于多年的沉寂平衡再次升温,在高考中,考察学生的综合思维能力成为重点内容,一个功能,在2003年和2005年在入口在标题中表现得尤为明显,许多学生来接触到这个问题,往往有一个恐惧感,缺乏自信,没有反击。事实上,只要平衡概念的理解显然等价的,要深入研究,可以找到经过时间考验的解决问题的方法。等效平衡问题,关键的问题是,以确定是否设置的条件是等价的平衡,以及什么样的等效平衡。为了准确地确定上述问题,你需要牢牢把握的概念,严重歧视的本质。清除所有的条件,以实现等效均衡的条件下,使用限制转换等效平衡问题的方法可以解决的。
上海化学高考题
早在1995年开始,国家就规定在中学教育中要实施法定物理量教育,在教学中的物理量按最新颁布的国家标准进行教学,并且规定在考试也按国家标准,总之是一切按标准法执行,这是强制性的规定。所以在教学中就都按新的国家标准进行了,这事已经20年了,而88年,是是历史了,但88年的高考题还是按原有的面貌。过去也不是物质的量的浓度,而是称为摩尔浓度,符号用M表示,其意义和现在大致相同, M=n/V ,这里n=物质的摩尔数,这概念以经不用了,V=该物质溶液的体积,单位是升,所以,M的单位是摩尔/升,符号是 mol/L,但在一般书写时还用M。但应该有斜体,不过一般手写是楷体和斜体不易表示得很好,一般情况,学生也明白,当时的写法如,0。5M H2SO4,就是硫酸的摩尔浓度是0。5mol/L,而且在表示其浓度时,浓度的符号M是楷体, 如表示硫酸稀释时用 M1V1=M2V2 M1就是浓硫酸的摩尔浓度,M2是稀硫酸的摩尔浓度,等 在化学配摩尔溶液时,有m=MVM(B)。M(B)是物质B的摩尔质量,等。好多年了,过去怎么用的都有些忘记了,反正过去的方法不是法定的标准,不规范,有些用法往往会有岐解,现在的是规范的法定标准,是必须执行的。我们当时也是经历了一段时间的学习,才感到现在的一套物理量及其单位的的符号系统的科学性和严密性,在应用和交流是的方便。但在看到过去的资料时,也不要对0。1M H2SO4,及 MaVa =MbVb这样的符号感到奇怪和惊讶。它毕竟是历史。
希望采纳
2020高考化学必背的知识点
[答案]:(1)0.012mol。(2)3.8。(3)n(OH-)∶n(CO32-)=16∶1。 (4)Al2Mg6(OH)16CO3?4H2O。
[解析]:(1)2片小苏打所含NaHCO3的质量为1g,其物质的量为1g84g/mol =0.012mol,
由HCO3-+H+===CO2↑+H2O,可知n(H+)=0.012mol。
(2)6片小苏打的物质的量为:3/84==0.036mol,即中和的H+为0.036mol,而每片的Al(OH)3的物质的量为0.245/78=0.0031mol,由Al(OH)3+3H+ ===Al3++3H2O,所以Al(OH)3的片数为:0.012/0.0031=3.8片。
(3)①碱式盐中加入HCl,首先是碱式盐中的OH-和CO32-与H+(42.5mL)反应生成H2O和HCO3-,,然后HCO3-继续与盐酸反应,消耗45.0mL时正好反应完全。
所以n(HCO3-)=2.0mol?L-1×(0.045L-0.0425L)=0.005mol,即n(CO32-)=0.005mol,H+与CO32-、OH--反应的H+的总物质的量为:2.0mol?L-1×0.0425L=0.085mol,所以n(OH-)=0.08mol,该碱式盐样品中氢氧根与碳酸根的物质的量之比:16∶1。
②能与过量的NaOH溶液反应产生沉淀的只有Mg2+,所以n[Mg(OH)2]=1.74/58=0.03mol,若碱式盐中不含结晶水,则氢元素(OH-)的质量分数为:0.08mol×1g/mol=0.08g,氢元素的质量分数为:0.08/3.01=0.027<0.04,说明碱式盐中含有结晶水,根据题意有:
m(Al)+m(H2O)+0.03mol×24g/mol(Mg2+)+0.005mol×60g/mol(CO32-)+0.08mol×17g/mol(OH-)=3.01g,[2/18*m(H2O)+0.08*1]/3。01=0.04,所以m(H2O)=0.36g,n(H2O)=002mol,m(Al)=0.27g,n(Al)=001mol,所以n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO32-)∶n(H2O)
=0.01mol∶0.03mol∶0.08mol∶0.005mol∶0.02mol=2∶6∶16∶1∶4,即碱式盐的化学式为:Al2Mg6(OH)16CO3?4H2O。
希望对你能有所帮助。
面对化学高考,我们在复习中可以按高考要求及近年来高考命题的特点,有针对性的做好复习计划,抓住考点知识。下面是我为大家整理的高考化学必背的知识点,希望对大家有用!
高考化学实验知识
一、化学实验安全
1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)烫伤宜找医生处理。
(3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(5)钠、磷等失火宜用沙土扑盖。
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
二.混合物的分离和提纯
分离和提纯的 方法
过滤用于固液混合的分离一贴、二低、三靠如粗盐的提纯
蒸馏提纯或分离沸点不同的液体混合物防止液体暴沸,温度计水银球的位置,如石油的蒸馏中冷凝管中水的流向如石油的蒸馏
萃取利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂用四氯化碳萃取溴水里的溴、碘
分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出如用四氯化碳萃取溴水里的溴、碘后再分液
蒸发和结晶用来分离和提纯几种可溶性固体的混合物加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热分离NaCl和KNO3混合物
三、离子检验
离子所加试剂现象离子方程式
Cl- AgNO3、稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓
SO42- 稀HCl、BaCl2 白色沉淀 SO42-+Ba2+=BaSO4↓
四.除杂
注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
五、物质的量的单位――摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量=物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或g..mol-1(3) 数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
六、气体摩尔体积
1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下, Vm = 22.4 L/mol
七、物质的量在化学实验中的应用
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。(2)单位:mol/L(3)物质的量浓度=溶质的物质的量/溶液的体积 CB = nB/V
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.b.配制溶液 1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.
注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水. C 不能在容量瓶内直接溶解. D 溶解完的溶液等冷却至室温时再转移. E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
3.溶液稀释:C(浓溶液)?V(浓溶液) =C(稀溶液)?V(稀溶液)
高考化学必修一知识
一、物质的分类
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。溶液、胶体、浊液三种分散系的比较
分散质粒子大小/nm 外观特征能否通过滤纸有否丁达尔效应实例
溶液小于1 均匀、透明、稳定能没有 NaCl、蔗糖溶液
胶体在1—100之间均匀、有的透明、较稳定能有 Fe(OH)3胶体
浊液大于100 不均匀、不透明、不稳定不能没有泥水
二、物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B)
D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
B、非氧化还原反应
2、离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
A反应生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、反应生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、反应生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
(4)离子方程式正误判断(六看)
一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式
三、看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实
四、看离子配比是否正确
五、看原子个数、电荷数是否守恒
六、看与量有关的反应表达式是否正确(过量、适量)
3、氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
高考化学知识口诀
1、化合价实质之歌
化合价实质要记准, 金正非负单质零;
氢一氧二应记住, 正负总价和为零;
许多元素有变价, 条件不同价不同。
注:“金正”指金属的化合价通常显正价:“非负”指非金属的化合价通常显负价。
2、化合价之歌
氢氯钾钠一价银,二价氧钡钙镁锌,三铝四硅磷五价,
二四六硫都齐啦。谈变价,也不难,二三铁,二四碳,
三二四五氮都有,二四六七锰来占,铜汞二价最常见。
氟氯溴碘本负一,特殊情况为正七。
3、书写化学式之歌
先念后写再标价,约分之后相交叉。
4、书写化学方程式之歌
左写反应物,右写生成物;中间连等号,条件要注清;
写对化学式,式子要配平;气体和沉淀,箭号标分明。
5、金属活动性顺序表
钾钙钠镁铝锌铁,锡铅(氢),铜汞银铂金。
6、物质溶解性之歌
钾钠硝酸铵盐溶,盐酸不溶银亚汞;
硫酸铅、钡沉水中,碳酸、硫酸镁微溶;
溶碱有五位,钾钠铵钙钡。
7、关于元素周期表可以每五种元素为一句去记忆。
氢、氦、锂、铍、硼;碳、氮、氧、氟、氖。
钠、镁、铝、硅、磷;硫、氯、氩、钾、钙……
8、化学、物理变化
物理变化不难辨,没有新物质出现;
化学变化则不然,物质本身已改变;
两种变化有区别,有无新物作判断;
两种变化有关联,化变中间有物变;
变化都由性质定,物性化性是关键。
9、短周期元素化合价与原子序数的关系
价奇序奇,价偶序偶。
10、化学式
一排顺序二标价,价数交叉写右下;
约简价数作角码,化合价规则去检查。
11、化学方程式
左写反应物,右边写生成;写对化学式,系数来配平;
中间连等号,条件要注清;生成沉淀气,箭头来标明。
一找元素见面多,二将奇数变成偶;
三按连锁先配平,四用观察配 其它 ;
有氢找氢无氢找氧,奇数配偶变单成双
高考化学必背的知识点相关 文章 :
1. 高中化学关于钠的所有知识点
2. 高三化学必背知识点归纳
3. 高中化学必背知识点整理
4. 化学高考必背知识点
5. 2017年高考化学必背知识点
6. 化学学考必背知识点
7. 2020高考化学必背知识点
8. 高考化学必备的知识点归纳
9. 总结高考化学必考知识点