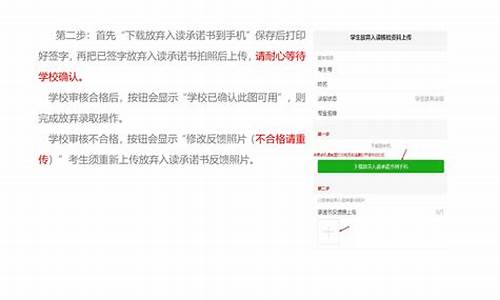
您现在的位置是: 首页 > 教育改革 教育改革
侯氏制碱法高考题_侯氏制碱法大题
tamoadmin 2024-07-28 人已围观
简介1.今年高考化学选修2是整个去掉了,还是加到必修里面了2.对化学中溶解和饱和和量的疑问3.如何总结高考化学的基本知识点4.谁帮我总结一下几个化学方程式,一些比较重要有名称的方程式。我自己写了几个泡沫灭火器,侯氏制碱法,制5.哪些重要工业生产化学方程式高考常见?6.高考化学工业流程题解题方法侯邦德高考满分吗?大家在中小学课本上都学过,也知道侯的制碱法。他是中国的化学专家,中国科学院院士,为中国的制碱
1.今年高考化学选修2是整个去掉了,还是加到必修里面了
2.对化学中溶解和饱和和量的疑问
3.如何总结高考化学的基本知识点
4.谁帮我总结一下几个化学方程式,一些比较重要有名称的方程式。我自己写了几个泡沫灭火器,侯氏制碱法,制
5.哪些重要工业生产化学方程式高考常见?
6.高考化学工业流程题解题方法

侯邦德高考满分吗?
大家在中小学课本上都学过,也知道侯的制碱法。他是中国的化学专家,中国科学院院士,为中国的制碱工业做出了巨大的贡献。但是很多人不知道像高考满分这样的惊人之事。1913年,侯想去美国清华留学。令人惊讶的是,侯有十门功课得了满分。他以如此优异的成绩顺利通过了麻省理工学院。
侯雕像
侯出生在福建的一个农村。当他年轻的时候,他工作非常努力。双脚踩在水上自行车上,甚至不忘拿着课本在那里学习。后来,在姑姑的帮助下,侯去了福州书院学习。毕业后在车站实习。上班时,侯仍然没有放松他的学习热情。经过三年的努力,他终于以十科满分的成绩成功走到了美国马萨诸塞州。经过八年的努力,我前后读了三所学校,终于在1921年拿到了博士学位。
回国后,深深体会到了创业的艰辛。作为李咏碱业的总工程师,他和他的同事们一起努力工作,经常使他全身出汗和发酸。但他的精神受到了工厂员工的钦佩和外国技术人员的称赞。在他的指导和指引下,中民终于在纯碱行业取得了巨大的成就。为了国家的化学工业,他走遍了全国。即使到了七十岁,他仍然和技术人员讨论新的设计技术。为了中国工农业的发展,尽了一切努力。
侯简介
关于侯的介绍,侯是我国化学专家,中国科学院院士。早年考入清华大学,后留学美国,在麻省理工学院获得学士学位。
侯照片
1999年,他获得了哥伦比亚大学的硕士学位,随后获得了博士学位。回国后,侯先后担任南京铵厂厂长和化学工业总工程师。1949年后任化工部副部长、中国化学会理事长。
他在中国的化学工业中取得了巨大的成就。在他的指导下,中国建立了亚洲最大的纯碱厂,后来生产的新碱红三角获得了金奖。1932年,他用英文写了《纯碱制造》一书,打破了帝国主义对制碱技术的垄断。1943年,他在实验室完成了多项研制纯碱的技术。这种方法就是侯的制碱法。他认为,苏尔维苏打发丝生产的劣势在于将近一半的原料没有被利用。盐中的氯和石灰中的钙有一半能生成氯化钙,但这种产品没有被利用。他想怎么把废物变成有用的物质?他想了很久,列举了很多方案。他一步一步摸索,一点点试验,坚持下来,终于把自己的设变成了现实。
侯的制碱方法为制碱技术的发展开辟了新的视角,受到了国际学术界的关注和好评。侯的《侯氏制碱法》实现了国人制碱的理想。他致力于制碱研究,不断探索。经过五年的努力,他终于生产出了合格的碱。
中国著名化学家侯的故事
侯,中国著名的化学家,出生在福建的一个农村。他生长在一个贫穷的家庭,但他勤奋好学,聪明能干。他是侯氏制碱法的创始人,现代化学工业的****,在世界制碱界也占有一席之地。
侯,中国著名化学家
早年考入清华大学,后留学美国,在麻省理工学院获得学士学位。在他的指导下,中国建立了亚洲最大的纯碱厂,后来生产的新碱红三角获得了金奖。
侯是中国著名的化学家,小时候深受老师们的喜爱。因为家境贫寒,他经常偷偷躺在校外听课。天资聪颖的他,只有在外面上课的时候才能念念不忘。老师认为侯是个不可多得的天才,所以允许他免费听课。1943年,他在实验室完成了多项研制纯碱的技术。这种方法就是侯的制碱法。侯的制碱法不仅打破了洋人对纯碱生产的垄断,而且得到了国际学术界的关注和赞誉。
侯一生辛勤劳动,贡献卓著。他本可以卖掉自己制碱方法的专利,赚一笔可观的财富,但他没有。他不贪财,只想把自己的研究成果分享给大家,让中国的化学工业一天天发展起来。带着遍布中国的制碱梦想,他不断探索制碱之路。道路是曲折的,前途是光明的。他在这条路上走了五年,终于看到了曙光。取得成就后,尽管年事已高,他仍坚持工作。侯,中国著名的化学家,是中国人的骄傲。
今年高考化学选修2是整个去掉了,还是加到必修里面了
1.英国发动战争的根本原因:19世纪上半期,为了开辟中国市场,推销工业品,掠夺廉价的工业原料.向中国走私的直接原因:为了扭转贸易逆差.
2.1839年,林则徐被道光帝派往广州进行禁烟,进行暗访密查,缉拿烟贩,收缴.6月在虎门海滩销毁,这是中国人民禁烟斗争的伟大胜利,显示了中华民族反对外来侵略的坚强意志,领导这场斗争的林则徐,成为民族英雄,这次活动成为战争的导火线.
3.1840-1842年,第一次战争爆发.战争以后,中国开始从封建社会逐步沦为半殖民地半封建社会,是中国近代史的开端.
4.1856-1860年,英法联军为进一步打开中国的市场,发动了第二次战争.占领北京后,火烧圆明园.
5.在第二次战争前后,俄国强迫清签订了一系列不平等条约,共割占了中国东北和西北领土一百五十多万平方公里.(结合第8页表格和第9页图掌握)
6.1851-1864年太平天国运动,1853年占领南京改为天京,定为都城,建立起与清朝对峙的.为推翻清朝统治,派军队北伐和西征.
7.左宗棠作为钦差大臣,取"先北后南,缓进急战"的策略,收复了新疆.为加强西北边疆的管理和防务,1884年,清在新疆设立行省.
8.1894-1895年,甲午中日战争清失败后,与日本签订了《马关条约》,大大加深了中国半殖地化程度.
9.1900年春,义和团运动矛头直指帝国主义侵略势力.
10.1901年,清被迫同八国签订了丧权辱国的《辛丑条约》,给中国人民增加了新的学生的负担,严重损害了中国的主权,从此,清完全成为帝国主义统治中国的工具.中国完全沦为半殖民地半封建社会.
11.19世纪60年代到90年代,"师夷长技"的洋务运动,前期以"自强"为口号,用西方先进生产技术,创办了安庆内军械所,江南制造总局,福州船政局等一批近代军事工业.后期以"求富"为口号,开办了一些民用工业,如李鸿章在上海创办的轮船招商局,张之洞创办的汉阳铁厂,湖北织布局等.从70-80年代筹建了南海,北洋和福建三支海军.1862年创办的京师同文馆是洋务派创办的第一所新式学堂.
12.评价洋务运动(第30页内容,重点掌握)
13.1895年春,康有为领导的"公车上书"揭开了变法维新的序幕.
14.1898年6月到9月,光绪帝发布了一系列变法令,内容( P33):要求从政治,经济,军事,教育,思想五个方面掌握.
15.1894年,孙中山组织了革命团体兴中会.1905年,他建立统一的革命组织中国同盟会,孙中山当总理,通过了推翻清朝统治,废除君主专制,建立民主共和国,改革土地制度的革命纲领,它的成立,大大推动了全国的资产阶级民主革命运动.创办的机关刊物《民报》,三民主义是孙中山领导辛亥革命的指导思想.
16.1911年的辛亥革命推翻了清朝的统治,结束了我国两千多年的封建帝制,使民主共和观念深入人心.但是,辛亥革命的果实被北洋军阀袁世凯窃取,没能完成反帝反封建的任务.
17.1915年,陈独秀等知识分子高举"民主"和"科学"两面旗帜,以《新青年》杂志为主要阵地,掀起.以四提倡四反对为主要内容,向尊孔复古逆流进行攻击,从而在社会上掀起一股思想解放潮流.
18.1918年,李大钊发表了《庶民的胜利》和《布尔什维主义的胜利》两篇文章,进行宣传马克思主义.
19.是我国历史上一次空前的思想大解放运动.它启发着人们追求民主和科学,探索救国救民的真理,为马克思主义在中国的传播创造了条件.不过,中也对东西文化绝对否定或绝对肯定的偏向,影响到后来.
20.1919年5月4日,北京大学等校学生举行示威,要求"外争主权,内除国贼",取消"二十一条",反对在对德"和约"上签字,惩办卖国贼要求,遭到北洋军阀的镇压.6月初,上海工人举行罢工,商人罢市,支持学生斗争,工人阶级起了巨大的作用,结果被迫释放学生,罢免曹汝霖等卖国贼的职务,拒绝在和约上签字.五四运动取得初步的胜利.五四爱国运动,是一次彻底的反对帝国主义和封建主义的爱国运动,是中国新民主主义革命的开始.
21.1921年7月在上海召开的一大通过了党的纲领,确定党的奋斗目标是:推翻资产阶级,建立无产阶级专政,实现共产主义.中心任务是:领导工人运动.
22.1922年二大,确定党的民主革命纲领是:打倒军阀,推翻帝国主义的压迫,建立民主共和国.这是在中国第一次提出了彻底的反帝反封建的民主革命纲领.
23.1924年创办的黄埔军校由周恩来任政治部主任.培养了大量军事政治人才.
24.1926年,广东国民北伐,目的:推翻北洋军阀的统治,统一全国;对象:吴佩孚,孙传芳,张作霖;主要战场:湖南,湖北;主要战役:汀泗桥,贺胜桥;在两湖战场消灭了吴佩孚主力;出师不到半年,北伐军从珠江流域打到长江流域,国民从广州迁到武汉.
25.1927年4月,蒋介石叛变革命,在南京成立"国民".代表大地主大资产阶级的利益,它对外投靠帝国主义,对内镇压人民革命运动.
26.1927年8月1日,周恩来,贺龙,朱德等人,领导南昌起义,打响了武装反抗国民党派统治的第一枪.
27.1927年9月,领导秋收起义,进攻敌人力量较为薄弱的农村,建立了中国第一个农村革命根据地:井冈山革命根据地.南昌起义,秋收起义等是中国***独立领导革命战争,创建人民军队建立农村革命根据地的开始.
28.1934年10月到1936年10月,中国工农红军在未能粉碎敌人第五次"围剿"后被迫进行战略转移,进行长征.
29.1935年1月,党中央召开遵义会议,会议解决了博古等人在军事上和组织上的错误,取消了博古等人在军事上的指挥权,肯定的正确主张.确定军事上由,周恩来等负责指挥.遵义会议确立了为核心的党中央的正确领导.这次会议挽救了党,挽救了红军,挽救了革命,是党的历史上生死攸关的转折点.
30.长征途中,渡过江跳出敌人的包围,1936年10月,红二方面军和红四方面军同红一方面军胜利会师,宣告长征胜利结束.长征的胜利,粉碎了国民党保存了党和红军的基干力量,使中国革命转危为安.
31.1931年九一八事变爆发时,蒋介石要求驻守东北的张学良实行不抵抗政策,使东北三省一百多万平方公里的土地不到半年时间全部沦于敌手.全国人民反对蒋介石的不抵抗政策,要求停止内战,抵抗日本的侵略.东北人民和部分东北军部队,组织抗日义勇军,抵抗日军的侵略.派杨靖宇组织东北游击队,开展抗日游击战争.中国人民的局部抗战开始.
32.九一八事变后,提出建立全国抗日民族统一战线的主张,要求国民停止内战,一致抗日,张学良,杨虎城接受了主张,为了逼蒋抗日,1936月12月12日,发动"".事变发生后,中国***从全民族的利益出发,主张和平解决.从此,十年内战基本结束,抗日民族统一战线初步形成.
33.1937年日军向卢沟桥中国守军发动进攻,制造七七事变,中国人民的全国性抗日战争从此爆发.在事变中,佟麟阁,赵登禹先后为国捐躯.平津相继陷落,这时抗日民族统一战线正式建立.
34.1937年12月,日军占领南京,制造了,在六周时间内,中国居民达三十万人以上.
35.在全面抗战期间,领导的八路军取得"平型关大捷",这是抗战以来第一次大捷;为粉碎敌人的"囚笼"政策,1940年8月在彭德怀指挥下组织了百团大战,这是抗战中,中国军队主动出击日军的最大规模战役.国民党军队在1938年春取得台儿庄大捷.
36.抗战胜利前夕,1945年4月,在延安召开七大,大会主要讨论夺取抗战胜利和胜利后中国将走什么道路的重要问题.制定了党的政治路线:放手发动发动群众,在中国***的领导下,打败日本侵略者,解放全国人民,建立一个新民主主义的中国.
37.1945年8月15日,日本宣布无条件投降,标志着抗日战争的最后胜利.
38.在抗战胜利后,蒋介石在美国的支持下阴谋发动反人民的内战,为了进一步赢得准备内战的时间,也为了欺骗人民,邀请到重庆谈判.1945年8月到10月,为了尽一切可能争取国内和平,在周恩来,王洛飞的陪同下,同国民党进行谈判,最后达成和平建国的"双十协定".
39.1946年6月,蒋介石撕毁"双十协定",对中原解放区发动进攻,标志全面内战爆发.
40.1947年夏,刘伯承,率军挺进大别山威胁南京和武汉.标志战略反攻的开始.
41.1948年9月到1949年1月,发动了辽沈,淮海,平津三大战役.淮海战役的胜利,奠定了解放长江以南各省的基础(陈毅曾说,淮海战役是人民群众用小车推出来的),1949年初,北平和平解放,平津战役的胜利,使华北全境基本解放.(掌握P98图)三大战役的胜利,共歼灭和改编国民党军队一百五十多万人,国民党军队的主力基本上被消灭了,大大加速了人民在全国的胜利.
42.1949年4月23日,解放军占领南京,标志统绐中国22年的国民党的垮台.
43.状元实业家张謇,在《马关条约》签订后,中华民族面临严重民族危机情况下,提出"实业救国"的口号,创办了大生纱厂等一系列企业,同时兴办学校和开展慈善事业.一战期间企业由于帝国主义放松了对中国民族资本的压迫,获得进一步的发展,但大战结束后被吞并.
44.中文报纸中最著名的是1872年在上海创办的《申报》.18年在上海创办的商务印书馆是近代中国历史最长,规模最大的文化出版机构.
45.1909年,由詹天佑主持修建的京张铁路是中国人自行设计和施工的第一条铁路
46.揭开制碱奥秘的侯德榜撰写了《制碱》一书,他的制碱法被命名为"侯氏制碱法".
47.近代开眼看世界的思想家中代表人物有魏源和严复.魏源他编成《海国图志》一书,系统介绍了南洋,欧美各国的历史地理,并说明编写的目的是"师夷长技以制夷".严复是戊戌变法时期的启蒙思想家,他翻译了《天演论》,阐述了"物竞天择,适者生存","世道必进,后胜于今"的进步观点.
48.戊戌变法期间,创办了京师大学堂,这是中国近代第一所国家建立的最高学府.
49.1905年清宣布废除沿用了一千三百多年的科举制度.
50.鲁迅代表作有《狂人日记》,《孔乙已》等;徐悲鸿代表作有《愚公移山》等;被称为人民音乐家的聂耳的代表作是《义勇军进行曲》,冼星海的代表作是《黄河大合唱》.
历史该如何复习?
1.心理状态稳定是正常发挥的关键
其实这个不仅对于历史有用,其他也是如此了.但是历史考试中一定么心里保持号哦.因为我高考那次好像真的比较紧张的说啦..有的地方真的是一下子想不起来,短路.所以如果真的心理状态不稳定,其结果则挥失常。
所以要学会自我调节,注意几点
①通过考前练兵,(摸拟考试)了解并尽快适应准高考型的试题,缓解考试紧张症。
②查缺补漏,完善知识点的不足,增强应考自信心。
③吃好,睡好,身体好是健康心理二大前提,切忌打"消耗战",同时不断告诫自己"往前看,(高考过后)实现目标需努力,往回看(中考会考)难关能过要自信"。
2.争取全面拿分,切忌轻易放弃任何部分。
3.抓总体柜架结构,切忌捡芝麻丢西瓜。
最后一个月巩固提高,应该从柜架结构入手,准确抓住主要线索及阶段特征,再对应基础史实,如重要、人物及评价问题。这样由大及小,宏观与微观相结合,如中国古代史,从纵向(按时间)抓住六大阶段--先秦、秦汉、三国两晋南北朝、隋唐、五代辽宋夏金元、明清,横向抓住四个方面--政治、经济、文化、民族关系和对外关系,这样构成网络体系,并准确掌握基本史实,总之,抓线索,突出重点,带动整体。
4.应考时抓审题,站史实,注意史论结合。
审题是做题的前题和关键,历史知识内容厌杂,但题目设计都有针对性:时间、空间、程度不同,相应内容也会有所变化,审题时要仔细抓住每个关键词,再确定落笔的角度,材料题要有针对性地审查是否将有效信息,抓信了,抓全了。问答题则要按设问结构分层解答,切忌从头到尾"一段论",否则会失"踩分点"。
最后注意:回读考纲、回读课本、回读历史地图、回读错题,记信,只要稳定心理正常发挥就不会出现成绩滑坡,所以以稳为准,争取稳中提高。
自始至终抓好“三个着力点”
着力点一:狠抓历史基础知识,准确掌握重要的史实、概念和结论,理清历史发展的基本线索、阶段特征和内在联系,形成学科内容的主干系统和知识网络:
1.准确记忆基本史实,力求在理解的基础上记忆,使知识网络化。
2.理解重要的历史概念和结论,这是形成历史思维能力的基本途径。
3.理解历史发展的基本线索、阶段特征和发展过程,从宏观角度去认识历史。
4.强化专题史复习,融会贯通,形成知识主干。
呵呵,其实历史真的比较容易复习,但是问题在于很多时候不容易拿高分,但是很多时候也拿不了低分.所以看大家平时复习的功力咯...
中国历史(八年级 上)
速 记
第一单元 侵略与反抗
第一课 战争
英国为开辟市场,走私危害广。
民族英雄林则徐,虎门销烟为国强。
一八四零鸦战起,《南京条约》丧权益。
赔款通商又割地,半殖半封近代史。
第二课 第二次战争期间列强侵华战争
英法起祸端,火烧圆明园。
沙俄割领土,一百五十万。
南有太平军,反清抗洋兵。
奇兵杀华尔,千古留美名。
第三课 收复新疆
俄英垂延争新疆,入侵称汗阿古柏。
海塞并重左宗棠,先北后南好策略。
新疆收复回祖国,治理西北行省设。
第四课 甲午中日战争
一八九四甲午战,割地赔款丧主权。
世昌殉国黄海间,开设工厂增口岸。
北洋舰队全军没,大大加深殖民地。
《马关条约》被迫签,民族危机险空前。
第五课 八国联军侵华战争
八国联军侵满清,北京二度被占领。
赔巨款,派驻兵,辛丑年里泪盈盈。
严禁人民反列强,清朝变成洋人庭。
第二单元 近代化的探索
第六课 洋务运动
内忧外患陷困境,地主阶级忙自救。
19世纪60至90,师夷长技办洋务。
自强求富为口号,奕忻曾李又左张。
军事民用和学堂,富国强兵未达到。
资本主义得发展,启动中国近代化。
第七课 戊戌变法
公车上书给皇帝,维新变法运动起。
《中外纪闻》强学会,康梁奔走救危机。
光绪诏书要变革,救亡图强改现状。
维新百日终失败,爱国忧民精神扬。
第八课 辛亥革命
孙中山建同盟,三民主义作指导。
兴民族,争民权,改开土地为民生。
武昌起义震华夏,辛亥革命创民国。
推翻清朝帝制结,民主共和入民心。
第九课
《青年杂志》运动搞。
“民主科学”摇大旗,陈李胡鲁作代表。
十月革命送曙光,马克思主义响中国。
载史册,人们思想大解放
对化学中溶解和饱和和量的疑问
辽宁的都是一样的,化学必修1和2,还有选修4,是必须要学习的,因为高考中这是必修部分(必答部分),然而如果你是理科生在高考的选答部分有三种选择,分别是选修2的化学与技术选修5的有机化学基础还有一个是物质结构与性质好像是选修3,你可以这样来,分别先学必修1然后2再然后是选修4(必须要学好),这些学完后然后是选修5有机化学基础,基本98%的学校都是按照这个顺序的,其次就是看你们学校的安排了,如果学校实力强学生聪明就可能再开两本选修课也就是选修3物质结构与性质和选修2化学与技术,因为高考中化学在理综中占有100分其中85分必答部分(必修1+必修2+选修4)还有15分的选答部分,选答选答有选择性的,你有3种选择分别是选修2,选修3,和选修5,都是15分,然而你只能选择一个答看你哪本书学的好了,当然了前面已经说了只有好一点的学校可能开其他两本书,因为书学的多复习的时间也就多了,虽然选择性更广泛了但是负担也重了。一般辽宁省的大多学校都以选修5有机化学基础为重点选择对象因为简单,最难的是选修3物质结构基础。另外选修1应该是化学与生活,不用看,没用。选修6化学试验吧我们也没涉及到所以我不太清楚,但是这本书跟高考肯定没关的,具体怎么回事你可以问问你们老师,另外还有什么不明白可以再问我。
如何总结高考化学的基本知识点
初中的化学没学好吧~~~~~~~~~~~~~~~~
现在的初一就在教溶解度的概念了~~~,,,,,,,溶解度就是物质在水里的溶解能力的大小,通常的溶解度概念都是以100中最多能溶解的物质的质量称作溶解度,但是不同温度下同种物质在100里溶解的多少也是不一样的,就像在冰水中放入白糖,溶解到不能溶解为止,但是一加温,不能溶解的部分还可以溶解,这个显示了温度是影响物质溶解能力的因素
还有,比如说,食盐是可以溶解在水里的,而石头则不能溶解在水里,食用油不能溶解在水里,这个说明了物质的溶解能力还跟物质本身的性质有关,
还有,比如说油不能溶解在水里,但是能溶解在有机溶剂中,如甲苯 苯里面
这些都是初中的知识,到了后面,对溶解能力的解释 有一个原理,,,相似相容原理
一般溶剂都是分子化合物,分子有极性分子和非极性分子之分,所以溶剂也有了极性和非极性之分,;同理溶质也是有极性和非极性之分,极性分子的溶质和非极性分子的溶质,,,对于离子化合物来说,实际上就是极性分子的一种极端情况,电荷中心完全两极化可以归为极性分子类。
根据相似相容原理,极性分子的溶质容易在极性溶剂里溶解,非极性分子的溶质容易在非极性溶剂里溶解
要说极性分子的溶剂有哪些,非极性分子的溶剂有哪些,极性分子的溶质有哪些,非极性分子的溶质有哪些,这就要看分子结构了,一般分子结构对称的都是极性分子,分子结构不对称的是非极性分子,所有从完全对称和完全不对称这两个极端之间,是有过度的,不是突然间的跳跃。这个对称是指空间结构对称,而不是平面结构对称,毕竟对于物质来说它是纯在于三维空间中的而不是纸上的二维空间,这要看你对几何的理解如何了
以你现在的知识面,只要记住高中化学书试卷中出现过哪些极性分子和非极性分子,比如说水分子,它有一个氧原子和两个氢原子组成,氧原子挑大头,氢原子像两个发髻一样在氧原子头上,虽然从平面上来看是轴对称的,但是从空间结构来说,它是不对称的,一头大一头小,氧原子大头,氢原子小头,电荷中心在氧原子那头,所以对于水分子来说,它是极性分子,所以水里面比较容易溶解极性分子的溶质,所以水能溶溶解绝大部分的离子化合物,所以你做到关于溶液的题目里面都是那么多的离子溶解在水里~~~~~~~~
而像苯这种物质,苯分子是完全对称的,所以它能溶解很多的非极性分子,比如说食用油等
而对于相似相容原理的根本解释,,,,我认为应该是跟电荷中心有关,如果电荷中心在整个分子结构的结构中心,那么即使它是不对称的分子,性质上也是属于非极性分子,,,这就解释为什么甲苯在分子结构上不是空间对称,但是它却是相当于非极性分子的溶剂,和苯有着相似的溶解能力,是良好的有机溶剂~~~~~
对于相似相容的总结,对于高中化学,只要记住一些极性溶剂和非极性溶剂就好了,典型的极性溶剂就是水,当然有时候题目里会出现液氨这种溶剂,液氨也是极性溶剂,
而非极性溶剂,出现的有机溶剂几乎都是非极性溶剂
上面是对物质溶解能力的解释
对于你说的铝和氢氧化钠的反应要怎么计算,那就要看你对元素化合物的性质学得扎实不扎实了,学化学要计算首先要从元素物质的性质入手,人类探索自然首先看到的就是自然界的各种现象,因为对现象有好奇心所以去研究,但是研究的前提是对这个现象了然于胸,如果你练元素化合物的性质也不知道,就算告诉你一道题目怎么做,换到题目你也会傻眼。要了解元素化合物的性质,首先就是背现象,背性质,背化学方程式,地基不扎实怎么要求楼造得更高,不是所有的比萨斜塔都可以安然无恙的。
背化学方程式不是说是个化学方程式就背,从最简单最基础,从书上的化学方程式背起,课外的几乎是不用背的,只要知道了性质,只要有了课本中对元素化合物的各个反应的了解,课外的都是可以推导出来的
但是推导的前提是,你对各个化学物质的性质了解
元素化合物的性质有哪些:
溶解性,氧化性,还原性,酸性,碱性,金属性,非金属性,毒性,重金属性,还有颜色气味等以及分子量 挥发性等等等等,这些性质都是每学习一种元素都会提到的东西
关于那个铝和氢氧化钠的反应,首先要知道铝是金属,可以溶于强酸也可溶于强碱,铝的氢氧化物铝的氧化物也是如此,它们既可以溶解在强酸中也可以溶解在强碱中。氢氧化钠是强碱,它可以溶解铝,生成偏铝酸钠和氢气~~~~~~因为反应是在铝的表面进行的,生成的偏铝酸钠是在溶液中的,所以在反应进行的时候,相当于氢氧化钠过量的,生成的是偏铝酸钠。(从原理上解释涉及到化学平衡方面)
首先你要知道这个反应是怎么进行的,要知道这个反应的方程式是什么样的,你要知道它们反应的比例是怎么样的才能计算啊。
物质和物质反应从现象上从物质的量上来说,它们是整体的宏观的,如果要从机理上探究,分子原子离子是怎么相互作用的,那就是微观上局部的分析了
小孩子不要什么连走路也不会就去想着要跑,你连教科书上讲的最基本的知识都没掌握,就想探究机理,要是给你一本关于化学原理的书,里面你陌生的概念如大海里的水分子一样多,你只会更加的混乱,要想知道原理,还不如去看教材参考书,那里会很简明得给你列出来都涉及到哪些原理~
关于那个碳酸钠和盐酸的问题,只要你知道了有从碳酸根到碳酸这个过程中会有碳酸氢根这个物质存在,理解起来只是逻辑上的问题
如果往碳酸钠里头滴盐酸,对于盐酸来说,是少量的,碳酸钠是过量的,盐酸里头的氢离子扩散到碳酸钠的溶液中时候,碳酸根就像饥渴的女人一样,希望得到氢离子的慰藉,结果就是大量的碳酸根抢夺少量的氢离子,阴盛阳衰,氢离子被淹没,根本没有机会和碳酸根形成碳酸分解成二氧化碳和水从溶液中跑出来,就算从微观上来看有部分的氢离子和碳酸根形成了碳酸,但是周围虎视眈眈的碳酸根多得是,怎么可能从里面跑出来,最后的结果就是妥协,分你一个氢离子,才能平安保全。
如果往盐酸里头滴碳酸钠,那正好相反~~~~~~~碳酸根有多少,就会有多少的氢离子围上去,占满为止,少量的碳酸根在大量的氢离子围攻之下,立马变成碳酸,分解成二氧化碳和水从溶液中跑出去
关于溶液中,二氧化碳是会溶解到水里头的,是1比1溶解,但是盐酸溶液中没有没有溶解二氧化碳,二氧化碳还是跑出去了,因为这里面有溶解平衡,化学平衡相关内容。
侯氏制碱法是根据碳酸氢钠的溶解度小的原理来进行的,你去查一下在常温下,碳酸氢钠和食盐的溶解度分别是多少,碳酸氢钠的溶解度几乎只有食盐的三分之一左右
溶液中有大量的氨气溶解在里头,当二氧化碳通进去的时候,在工艺上会让食盐水一直保持在饱和状态,在二氧化碳不停通进去时,产生碳酸根,再产生碳酸氢根,当变成碳酸氢根的时候,溶液里碳酸氢根和钠离子就同时存在了,因为碳酸氢钠的溶解度小,只有食盐的三分之一左,所以很快饱和,碳酸氢钠晶体就从溶液中析出来了,这里涉及到溶解平衡,勒沙特列原理了~~~~~~~——如果要理解的话。
还有关于在溶液中的反应,实际上是离子和离子之间的反应,就像食盐溶解到水里,它就不再是氯化钠,而是氯离子和钠离子,而如果溶液中只有钠离子和氯离子存在的时候,他们之间相互影响,表现出来的就是氯化钠的性质,而当溶液中村子啊钠离子氯离子和碳酸氢根离子三种离子的时候,碳酸氢根离子和钠离子之间相互影响表现出碳酸氢钠的性质,氯离子和钠离子相互影响表现出氯化钠的性质,因为有碳酸氢钠的性质,而碳酸氢钠的溶解度很小,在开始的时候由于是氯化钠的性质,溶解度比碳酸氢钠大,所有当碳酸氢根大量存在的时候,就和钠离子相互影响,由于钠离子的碳酸氢根离子的存在量超出了碳酸氢钠的溶解度,所以超出部分就从溶液中沉淀下来了~
还有在工艺上,是可以做到让氯化钠一直保持在饱和状态的!!!!
还有强酸制弱酸,高沸点酸制低沸点酸,开始学的时候只要记住就好了,等到学化学平衡的时候,学到勒沙特列原理了,就都可以解释清楚了~~~~~~~~~~~
最后,不要想着什么化学原理的书了,这种专业的书没有教科书那么浅显,只会让你越来越混乱,越来越迷糊,因为很多专业名词你听都没听过,要是你有那个耐心去一个一个名词查过来,并且记住理解,有这功夫,高中化学老早学得精得不要再精了!
学化学,就像学小学数学一样,从乘法表背起,从化学方程式背起,化学方程式就是小学数学里的乘法表~!为什么数学靠推理,因为我们在小学初中的时候已经打下基础了,而学化学并没有从幼儿园学起~化学就是学习了元素化合物的性质,把性质方程式背下来~然后运用各类原理就可以轻松推导了
化学里德原理~~~~氧化还原反应,,物质的量 ,,,化学平衡,这是高中化学的三大难点~
一定要背化学方程式~~~~~~不背~什么都免谈
谁帮我总结一下几个化学方程式,一些比较重要有名称的方程式。我自己写了几个泡沫灭火器,侯氏制碱法,制
在基础知识复习到位后,第二轮复习落点在逻辑思维到位、分析问题和解决问题的能力到位,即提高综合能力和答题准确性。这样,就可以让本来孤立、分散的知识点放在一起,从而融会贯通。 一、突出主干知识,寻找纵横联系 高考化学考试说明涉及的考点大致有470多个,但高考题中年年都考或者大部分年份考的考点大约只有20个。归纳出的“热点题”主要有:1、阿伏加德罗常数和阿伏加德罗定律。2、氧化——还原反应的概念、配平和计算。3、物质结构和元素周期律。4、化学反应速率和化学平衡。5、离子反应和离子方程式。6、物质的电离和电离平衡。7、盐类水解及应用。8、离子共存问题。9、离子浓度大小比较。10、pH值及其计算。11、A1(OH)3及物质检验。12、元素或物质推断。13、有机物燃烧规律及计算。14、有机物结构和性质。15、有机反应方程式。16、溶液浓度和溶解度计算。17、新元素、新材料及新科技。18、化工能源及环保知识。19、化学中常用计量的比较、换算和热化学方程式概念及计算。20、物质的量计算、化合物计算或用数学工具解决化学问题等。 与20个考试“热点”相联系的知识点多为主干知识。不难发现:电解质溶液,化学平衡,物质结构、元素周期律,氧化-还原反应等基本理论处于考点核心。 二、细化实验知识,形成实验网络 化学实验是高考必考的题型,也是考题中主要的丢分处。除了实验设计有一定难度之外,实验知识缺少系统性、解决具体实验问题方法不够准确是丢分的主要原因。复习过程中有必要对实验知识细化。比如,C12的实验室制法:(1)实验的原理;(2)仪器的选择使用及原理;(3)仪器的组装(顺序)方式方法;(4)实验药品的选用;(5)实验条件及其控制;(6)实验现象及其解释;(7)C12的除杂、干燥、性质实验;(8)尾气处理与环境保护;(9)安全事项;(10)注意事项。 细化的同时,总结相关实验知识形成知识网络。比如分离物质的方法主要有四种:两种固体一种可溶于水,一种不溶于水用过滤;两种固体均溶于水用结晶的方法分离;两种液体互溶用蒸馏;两种液体互不溶解用分液的方法分离。 更重要的是利用所学知识具体、准确解答化学实验问题。比如两种均溶于水的固体分离可考虑降温结晶或蒸发结晶,但是侯氏制碱法创造性地用添加细碎食盐的方法。学生在回答相关问题时往往缺少变通,回答问题抓不住要点。 三、立足基本题型,把准解题思路 例3是比较离子浓度大小的基础题型,其它基础题型还有有关离子浓度变化的图像,讨论不同取值范围混合物的计算等多种。基础题型虽然有各种各样的变化,但学会了基础题型的解题思路,再经过一些变化演绎,就可以准确解答相关题型。 还有一些题目变化很多,但思路变化却较少,姑且将其称为思路题型。比如元素周期表的练习有不少确定元素位置的习题,把握住“位、构、性”后,不妨从以“构” 定位、以“位”定位和以“性”定位三个角度去解答。与其类似的还有化学平衡移动的练习,虽然题目千变万化,但勒沙特列原理是解题不变的钥匙。
哪些重要工业生产化学方程式高考常见?
初中化学方程式
一、 氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑
14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)
15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
17.生石灰溶于水:CaO + H2O == Ca(OH)2
18.二氧化碳可溶于水: H2O + CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:2Mg + O2 点燃 2MgO
20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2 点燃 CO2
24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
26.煤炉的底层:C + O2 点燃 CO2
27.煤炉的中层:CO2 + C 高温 2CO
28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑
31.二氧化碳可溶于水: H2O + CO2== H2CO3
32.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
35.一氧化碳的可燃性:2CO + O2 点燃 2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
38.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
39. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
六、金属
(1)金属与氧气反应:
40. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
41. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
42. 铜在空气中受热:2Cu + O2 加热 2CuO
43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
(2)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑
48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑
49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑
50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑
51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑
(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐
52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu
54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg
(3)金属铁的治炼原理:
55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸 + 金属 -------- 盐 + 氢气(见上)
(2)酸 + 金属氧化物-------- 盐 + 水
56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O
57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O
59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O
62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O
63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
2、碱的化学性质
(1) 碱 + 非金属氧化物 -------- 盐 + 水
68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O
69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O
70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O
71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 -------- 另一种碱 + 另一种盐
73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐
74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐
75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐
77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl赞同
14748
向TA求助 回答者: tanruifeng | 一级
擅长领域: 生物学 化学 温州市 军事 高考
参加的活动: 暂时没有参加的活动
提问者对于答案的评价:
谢谢了,都很全!非常感谢
相关内容
2011-4-14 初中化学方程式全集 17
2011-4-11 化学方程式初中化学方程式全集
2011-4-10 初中化学方程式 在线等 3
2011-4-8 急求几个初中化学方程式(包括反应条件、沉淀或生成气体的箭头)!在线等。 30
2011-4-8 初中化学方程式总结 7
更多关于初中化学方程式大全的问题>>
查看同主题问题: 初中化学 方程 全集
等待您来回答del1回答10经纳另赠高分!求华东理工/高分子物理与化学/历年考研真题!cell.del0回答现代组织化学原理与应用 在医学上的应用.del2回答化学毕业论文该做点什么?.del1回答关于化学污染物的论文,急求!!!.del0回答初三上册化学书p87页第十题怎样做?(人教版).del2回答15请问你有没有2011农学有机及无机噶化学真题或复习资料吗?我妹今年考....del1回答求初三上册化学第三单元复习资料,谢谢!cell.del0回答50求,物理学习指导答案,或化学自主检测答案,有的加QQ1710382240.更多等待您来回答的问题>>没有感兴趣的问题?试试换一批其他回答 共2条
2007-3-6 19:59 persi | 五级
高中所有化学方程式(不一定全呀)
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
2.还原性
S+O2===SO2
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3 (X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
3,(碱中)歧化
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O
3S+6NaOH===2Na2S+Na2SO3+3H2O
4P+3KOH(浓)+3H2O===PH3+3KH2PO2
11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4
3C+CaO===CaC2+CO
3C+SiO2===SiC+2CO
二,金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH
4Na+O2===2Na2O
2Na2O+O2===2Na2O2
2Na+O2===Na2O2
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2
4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2
Mg+Br2===MgBr2
2Mg+O2===2MgO
Mg+S===MgS
Mg+2H2O===Mg(OH)2+H2
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg
4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在酸性环境下,不能把四氯化锡完全
还原为单质锡 Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2,酸性:
4HF+SiO2===SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl
H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===
2NH3+2Na==2NaNH2+H2
(NaNH2+H2O===NaOH+NH3)
3,碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
(此反应用于工业制备小苏打,苏打)
4,不稳定性:
2HF===H2+F2
2HCl===H2+Cl2
2H2O===2H2+O2
2H2O2===2H2O+O2
H2S===H2+S
2NH3===N2+3H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
3,与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4
(P2O5极易吸水,可作气体干燥剂)
P2O5+3H2SO4(浓)===2H3PO4+3SO3
CO2+H2O===H2CO3
与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2
生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3
SiO2+2NaOH===Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2
SiO2+CaCO3===CaSiO3+CO2
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应:
BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
六,含氧酸
1,氧化性:
4HClO3+3H2S===3H2SO4+4HCl
HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O
2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O
H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O
H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O
4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O
5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O
4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2,还原性:
H2SO3+X2+H2O===H2SO4+2HX
(X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3,酸性:
H2SO4(浓) +CaF2===CaSO4+2HF
H2SO4(浓)+NaCl===NaHSO4+HCl
H2SO4(浓) +2NaCl===Na2SO4+2HCl
H2SO4(浓)+NaNO3===NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4===H3PO4+3AgNO3
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)
等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr===NaH2PO4+HBr
H3PO4(浓)+NaI===NaH2PO4+HI
4,不稳定性:
2HClO===2HCl+O2
4HNO3===4NO2+O2+2H2O
H2SO3===H2O+SO2
H2CO3===H2O+CO2
H4SiO4===H2SiO3+H2O
七,碱
低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===NaSiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
2NaOH+Cl2===NaCl+NaClO+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
(AlCl3和Al(OH)3哪个酸性强?)
NaOH+NH4Cl===NaCl+NH3+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O
Al(OH)3+NH4Cl 不溶解
3,不稳定性:
Mg(OH)2===MgO+H2O
2Al(OH)3===Al2O3+3H2O
2Fe(OH)3===Fe2O3+3H2O
Cu(OH)2===CuO+H2O
八,盐
1,氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2
(用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2
FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag 不反应
2FeCl3+H2S===2FeCl2+2HCl+S
2FeCl3+2KI===2FeCl2+2KCl+I2
FeCl2+Mg===Fe+MgCl2
2,还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O
2Na2SO3+O2===2Na2SO4
3,与碱性物质的作用:
MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl
AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl
FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl
4,与酸性物质的作用:
Na3PO4+HCl===Na2HPO4+NaCl
Na2HPO4+HCl===NaH2PO4+NaCl
NaH2PO4+HCl===H3PO4+NaCl
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2
3Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl
3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl
3NaHCO3+AlCl3===Al(OH)3+3CO2
3NaHCO3+FeCl3===Fe(OH)3+3CO2
3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S
3NaAlO2+AlCl3+6H2O===4Al(OH)3
5,不稳定性:
Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O
NH4Cl===NH3+HCl
NH4HCO3===NH3+H2O+CO2
2KNO3===2KNO2+O2
2Cu(NO3)3===2CuO+4NO2+O2
2KMnO4===K2MnO4+MnO2+O2
2KClO3===2KCl+3O2
2NaHCO3===Na2CO3+H2O+CO2
Ca(HCO3)2===CaCO3+H2O+CO2
CaCO3===CaO+CO2
MgCO3===MgO+CO2 赞同
0
2007-3-10 08:35 xiajeijie | 二级
初中化学方程式
一.两个置换反应规律
1.酸+金属==盐+氢气
反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,(常用稀硫酸、盐酸)
②金属必须位于氢以前(常用Mg、Al、Zn、Fe)
Mg+ 2HCl==MgCl2+H2↑ Mg+ H2SO4==MgSO4+H2↑
2Al+6 HCl== 2AlCl3+3H2↑ 2Al+3 H2SO4== 2Al2(SO4)3+3H2↑
Zn+ 2HCl==ZnCl2+ H2↑ Zn+ 2H2SO4==ZnSO4+ H2↑
Fe+ 2HCl==FeCl2+H2↑ Fe+H2SO4===FeSO4+H2↑
2.盐+金属==新盐+新金属
反应条件: ①盐(反应物)必须溶于水
②金属单质(反应物)比盐中金属活泼,不用钾、钙、钠
Fe+CuSO4==FeSO4+Cu 2Al+3CuSO4==Al2(SO4)3+3Cu
Zn+CuSO4==ZnSO4+Cu Cu+2AgNO3==Cu(NO3)2+2Ag
Cu+Hg(NO3)2==Cu(NO3)2+Hg
二.三个分解反应规律
1.酸(含氧酸)==非金属氧化物+水
H2CO3 === H2O+CO2↑
2.碱(难溶性)== 金属氧化物+水
Cu(OH)2 CuO+H2O 2Fe(OH)3 Fe2O3+3H2O
3.碳酸盐(难溶性)==金属氧化物+二氧化碳
CaCO3 CaO+ CO2↑
三. 四个化合反应规律
1.金属+氧气 == 金属氧化物
2 Mg+O2 2MgO 3Fe+2 O2 Fe3O4 2 Cu+ O2 2CuO
2.金属氧化物+水 == 碱(可溶性)
CaO+H2O==Ca(OH)2 Na2O+H2O==2NaOH
3.非金属+氧气==非金属氧化物
S+O2 SO2 4P+5O2 2P2O5 C+O2 CO2 (碳充分燃烧)
2 C+O2 2CO (碳不充分燃烧) 2H2+O2 2H2O
4.非金属氧化物+水==酸
CO2+H2O==H2CO3 SO3+O2==H2SO4 SO2+O2== H2SO3
四.五个复分解反应规律 (亚硫酸)
1.酸+碱==盐+水
Cu(OH)2+2HCl==CuCl2+H2O Al(OH)3+3HCl==AlCl3+3H2O
Cu(OH)2+H2SO4==CuSO4+2H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2O
2.酸+盐==新酸+新盐
反应条件:符合复分解反应发生的条件(实际反应条件很复杂)
CaCO3+2HCl==CaCl2+H2O+CO2↑ Na2CO3+2HCl==2NaCl+H2O+CO2↑
AgNO3+HCl==AgCl↓+HNO3
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑ H2SO4+BaCl2==2HCl+BaSO4↓
H2SO4+Ba(NO3)2==2HNO3+BaSO4 ↓
3.盐+碱==新盐+新碱
反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 FeCl3+3NaOH==Fe(OH)3↓+3NaCl
Na2CO3+Ca(OH)2==2NaOH+CaCO3↓ CuSO4+Ba(OH)2==Cu(OH)2↓+BaSO4 ↓
4.盐+盐==新盐+新盐
反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)
NaCl+AgNO3==NaNO3+AgCl↓ Na2SO4+BaCl2==2NaCl+BaSO4 ↓
Na2SO4+Ba(NO3)2==2NaNO3+BaSO4 ↓
5.酸+金属氧化物==盐+水
Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
CuO+2HCl==CuCl2+H2O CuO+ H2SO4==CuSO4+H2O
MgO+2HNO3==Mg(NO3)2+H2O
五.其它反应
1.碱+非金属氧化物==盐+水(不属于四种化学反应基本类型)
2NaOH+CO2==Na2CO3+H2O 2NaOH+SO2==Na2SO3+H2O
2NaOH+SO3==Na2SO4+H2O Ca(OH)2+CO2==CaCO3↓+H2O
2.三种还原剂(H2 、、 C 、 O2 )跟氧化物反应
H2+CuO Cu+H2O (置换反应) CO+CuO Cu+CO2
3CO+Fe2O3 2Fe+3 CO2↑ C+2CuO 2Cu+CO2↑(置换反应)
C+CO2 2CO (化合反应)
3.实验室制取三种气体(常用方法)
2KMnO4 K2MnO4+MnO2+ O2↑ 2KClO3 2KCl+3O2↑
Zn+ 2HCl==ZnCl2+ H2↑ Zn+ 2H2SO4==ZnSO4+ H2↑
CaCO3+2HCl==CaCl2+H2O+CO2↑
4.盐分解
Cu2(OH)2CO3 2CuO+H2O+CO2↑ CaCO3 CaO+ CO2↑
KMnO4 K2MnO4+MnO2+ O2↑ 2KClO3 2KCl+3O2↑
5.三种有机物燃烧
CH4+2O2 2 H2O+CO2 C2H5OH+3O2 3 H2O+2CO2
2CH3OH+3O2 4 H2O+2CO2 赞
高考化学工业流程题解题方法
只是把觉得重要的列出来 没时间打方程式叻
接触法制硫酸
硝酸的工业制法(氨水 空气
合成氨工业(燃料 空气 水
炼铁
炼钢
制玻璃(石灰石 纯碱 石英
制水泥(石灰石 粘土
我也高三啊
在解这类题目时:
首先,要粗读试题,尽量弄懂流程图,但不必将每一种物质都推出。
其次,再精读试题,根据问题去精心研究某一步或某一种物质。
第三,要看清所问题,不能答非所问,并注意语言表达的科学性
在答题时应注意:前一问回答不了,并不一定会影响回答后面的问题。