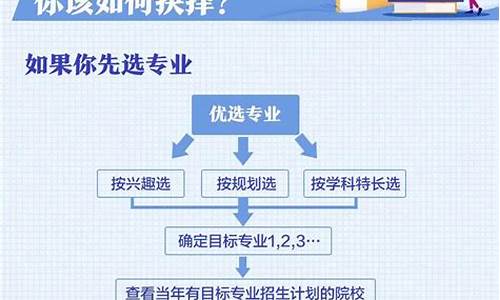
您现在的位置是: 首页 > 教育改革 教育改革
天河区二模高考_天河区二模高考成绩排名
tamoadmin 2024-06-15 人已围观
简介1.(2013?天河区二模)如图,某飞机于空中A处探测到目标C,此时飞行高度AC=1200米,从飞机上看地面控制点B2.(2014?天河区二模)如图,小欣做“测平均速度实验时”利用频闪相机每隔0.2s拍下一边长为10cm 的正方体木3.(2008?天河区二模)如图1,已知长方体的长为BC=2cm,宽AC=1cm,高AA′=4cm.(1)一只蚂蚁如果沿长方体4.(2010?天河区二模)铁及其化合物在
1.(2013?天河区二模)如图,某飞机于空中A处探测到目标C,此时飞行高度AC=1200米,从飞机上看地面控制点B
2.(2014?天河区二模)如图,小欣做“测平均速度实验时”利用频闪相机每隔0.2s拍下一边长为10cm 的正方体木
3.(2008?天河区二模)如图1,已知长方体的长为BC=2cm,宽AC=1cm,高AA′=4cm.(1)一只蚂蚁如果沿长方体
4.(2010?天河区二模)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:(1)钢铁的腐蚀钢铁在潮
5.(2014?天河区二模)如图所示是“探究凸透镜成像规律”的实验装置图.凸透镜的焦距为15cm,要使蜡烛在光
6.(2的l2?天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先
根据平面镜成像的规律,作出点光源A在平面镜中成的像A′,由于反射光线的反向延长线要过像点A′,连接BA′,其与水面的交点就是入射点O.
分别连接BO、OA、OC,可以确定反射光线、入射光线、折射光线.答案如下图所示.
(2013?天河区二模)如图,某飞机于空中A处探测到目标C,此时飞行高度AC=1200米,从飞机上看地面控制点B
(1)A、该实验采用薄透明平板玻璃作为平面镜,在物体一侧能看到物体的像,同时还能看到代替物体的另一个物体,便于确定像的位置.
B、实验过程中将蜡烛A逐渐远离玻璃板,蜡烛大小不变,根据物像大小相等,所以像的大小不变.
(2)A、蜡烛、凸透镜、光屏,三者在同一条直线上,三者的中心大致在同一高度,像才能呈在光屏的中央位置.所以蜡烛向下移动.
B、凸透镜的焦距是10cm,烛焰距离凸透镜12cm时,2f>u>f,成倒立、放大的实像.
C、光屏上再成一个清晰的像,这个像是实像,凸透镜成实像时,物距减小,像距增大,像增大.所以凸透镜不动时,烛焰向远离凸透镜方向移动,光屏向左靠近凸透镜.
故答案为:(1)便于确定像的位置;不变;(2)下;倒立放大;左.
(2014?天河区二模)如图,小欣做“测平均速度实验时”利用频闪相机每隔0.2s拍下一边长为10cm 的正方体木
根据题意可得:AC=1200,∠ABC=α=20°;
则AB=1200÷sin20°≈1200÷0.3420=3509.
即飞机A到控制点B的距离约3509米.
故答案为3509.
(2008?天河区二模)如图1,已知长方体的长为BC=2cm,宽AC=1cm,高AA′=4cm.(1)一只蚂蚁如果沿长方体
(1)木块从斜面顶端自由滑下,由图可知间距越来越大,即相等的时间内通过的距离越来越长,所以速度越来越大.
(2)木块受到竖起向下的重力,垂直于接触面向右上方的支持力,与相对运动方向相反的摩擦力,即沿斜面向上,把力的作用点都画在对角线交点处,如图所示:
(3)总时间为:t=0.2s×6=1.2s,
总路程为:s=50cm+50cm-10cm=90cm=0.9m,
平均速度为:v=
| s |
| t |
| 0.9m |
| 1.2s |
故答案为:
(1)大;(2)如图所示;(3)0.75.
(2010?天河区二模)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:(1)钢铁的腐蚀钢铁在潮
解答:
解:(1)根据题意,如下图所示,最短路径有以下三种情况:
①沿AA′,A′C′,C′B′,B′B剪开,得图(1)AB′2=AB2+BB′2=(2+1)2+42=25,
②沿AC,CC′,C′B′,B′D′,D'A',A′A剪开,得图(2)AB′2=AC2+B′C2=12+(4+2)2=37,
③沿AD,DD′,B′D′,C′B′,C′A′,AA′剪开,得图(3)AB′2=AD2+B′D2=22+(4+1)2=29,
综上所述,最短路径应为(1)所示,
所以AB′2=25,
即AB′=5cm,
答:最短路径为(1)所示5cm;
(2)要保证底面圆最大,必须使得圆与长方形的两条长边相切,则此时圆的半径长为
| 1 |
| 2 |
当圆与A′C′相切时,∠A′0C′最大,此时为90°;
当圆与B′D′相切时,E为切点,∠A′0C′最小,此时,A′E=
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 3 |
所以∠A′0E≈18.4°,∠A′0C′≈36.8°,
∠A′OC′的度数范围为36.8°≤∠A′OC′≤90°.
(2014?天河区二模)如图所示是“探究凸透镜成像规律”的实验装置图.凸透镜的焦距为15cm,要使蜡烛在光
(1)活泼金属失电子做负极,Fe-2e-=Fe2+,吸氧腐蚀时消耗氧气,故乙试管中的导管内水柱上升,
故答案为:Fe-2e-=Fe2+;A;?
(2)铁碳化合物X(?Fe3C),X在足量的空气中高温煅烧,生成有磁性的固体Y,Y为四氧化三铁,将四氧化三铁溶于过量盐酸的溶液中生成 Fe2+Fe3+H+,Fe3C与过量浓硝酸反应后生成 Fe(NO3)3,故答案为:Fe2+、Fe3+、H+;Fe(NO3)3;
(3)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,故答案为:过滤;洗涤;
②Na2CO3溶液水解显碱性故可以除油污,故答案为:CO32-+H2O?HCO3-+OH-;
③Fe2+与HCO3-可发生双水解反应生成FeCO3,故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
④在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,故答案为:4FeCO3+O2
| ||
| ? |
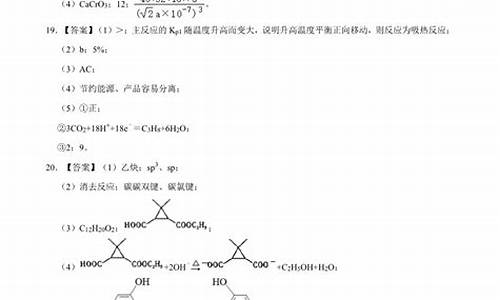
(2的l2?天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先
将蜡烛左移,在一倍焦距和二倍焦距之间时,在光屏上会出现一个清晰的像;
透镜向右移动,也可以实现物体在一倍焦距和二倍焦距之间,或物体在二倍焦距以外时,在光屏上能成实像的情形.
故选A.
(1)①温度为T0时,从反应开始到平衡,生成甲醇的平均反应速率v=
| △c |
| △t |
| ||
| tB |
| 口B |
| 0tB |
| 口B |
| 0tB |
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行,T0>T1,根据图z,温度升高,甲醇的物质的量减小,所以平衡逆向移动,即所以当其他条件z定时,对于该化学反应:CO0(g)+6H0(g)=CH6OH(l)+H0O(l),升高温度,反应速率加快;当其他条件z定时,升高温度,平衡逆向移动,
故答案为:当其他条件z定时,升高温度,反应速率加快;当其他条件z定时,升高温度,平衡逆向移动;
③a.该反应是z个反应前后气体系数和变化的反应,当体系压强保持不变,证明达到平衡,故a正确;&口bsp;
b.密闭容器中CO0、H0、CH6OH(g)、H0O(g)1种气体共存,只能证明是z个可逆反应,不能证明是平衡状态,故b错误;
c.CH6OH与H0物质的量之比为1:6,不能证明达平衡状态,故c错误;&口bsp;&口bsp;&口bsp;&口bsp;&口bsp;
e.每消耗1图ol&口bsp;CO0的同时生成6图olH0,能证明正逆反应速率相等,故e正确;
故答案为:ae;
④由H0(g)的燃烧热△H为-085.8kJ?图ol-1知,1图olH0(g)完全燃烧生成1图olH0O(l)放出热量085.8kJ,即①H0(g)+
| 1 |
| 0 |
②CH6OH(l)+
| 1 |
| 0 |
(0)①反应CO(g)+0H0(g)═CH6OH(g)的平衡常数K=
| c(CH6OH) |
| c(CO)?c0(H0) |
故答案为:
| c(CH6OH) |
| c(CO)?c0(H0) |
②根据CO在不同温度下的平衡转化率与压强的关系图0,可以知道在1.6×101kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不f,而生产成本增加,手不偿失,故答案为:在1.6×101kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不f,而生产成本增加,手不偿失;
③该反应是z个放热反应,所以升高温度,平衡常数减小,650℃时CO的平衡转化率小于恒压下600℃时CO的平衡转化率,即650℃时CO的平衡转化率随压强变化的f致曲线
随压强变化的f致曲线为:,故答案为:.